Respuesta morfogenética de Agave angustifolia al gradiente auxina-citocinina durante el desarrollo de embriones somáticos indirectos
DOI:
https://doi.org/10.18387/polibotanica.60.18Palabras clave:
Agave angustifolia, callogénesis, embrión somático, auxina, citocininaResumen
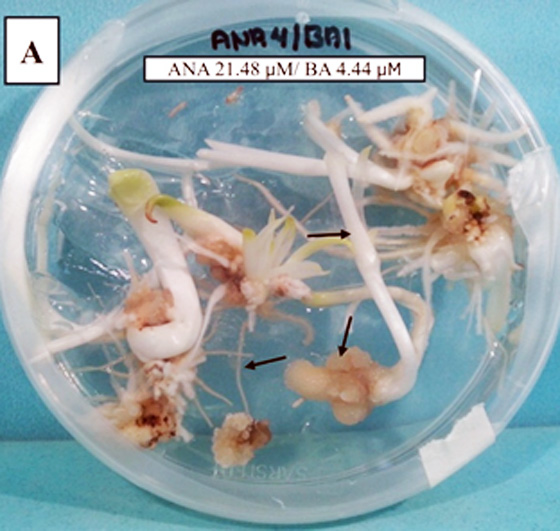
Agave angustifolia es una especie de alto valor para la agroindustria mezcalera mexicana. Sin embargo, la creciente demanda contrasta con la escasez de germoplasma de calidad y la baja eficiencia de los métodos de propagación convencionales. En este contexto, la embriogénesis somática se presenta como una estrategia biotecnológica prometedora para la regeneración masiva de plantas élite en condiciones controladas. El objetivo del estudio fue evaluar el efecto de tres auxinas (2,4-diclorofenoxiacético [2,4-D], ácido indolacético [AIA] y ácido naftalenacético [ANA]) combinadas con bencilaminopurina (BA) sobre la inducción de embriogénesis somática en A. angustifolia, a partir de ejes embrionarios cigóticos. Se aplicó un diseño experimental completamente al azar para evaluar 27 combinaciones hormonales, derivadas de la interacción factorial de tres concentraciones de auxinas (3.0, 4.0 y 5.0 mg L⁻¹) y tres de BA (1.0, 2.0 y 3.0 mg L⁻¹). Se utilizó como medio basal para inducir las masas proembriogénicas el MS al 25 % con 60 g L⁻¹ de sacarosa y vitaminas L2, cada eje embrionario cigótico se consideró como una unidad experimental. A los 60 días de cultivo, los callos obtenidos fueron transferidos a un medio MS de histodiferenciación con 0.1 mg L⁻¹ de la auxina correspondiente y sin BA. Todos los cultivos se mantuvieron en oscuridad por 30-60 días adicionales para favorecer la diferenciación embrionaria. Las combinaciones con 2,4-D + BA indujeron formación de callo en un 71 % de los explantes, con prevalencia de estructuras embriogénicas. La combinación más efectiva fue 5.0 mg L⁻¹ de 2,4-D + 3.0 mg L⁻¹ de BA, con un rango de 1 a 36 embriones somáticos por explante y una eficiencia embriogénica de 17.6 ± 7.1. Las combinaciones con ANA + BA promovieron principalmente rizogénesis (87 %), sin formación de embriones, mientras que las de AIA + BA fueron ineficaces (≤ 10 %), con tejidos oxidados y sin desarrollo morfogénico. Las plántulas regeneradas a partir de embriones somáticos germinaron adecuadamente y mostraron una tasa de supervivencia del 100 % al ser aclimatadas en condiciones ex vitro. La combinación de 5.0 mg L⁻¹ de 2,4-D y 3.0 mg L⁻¹ de BA resultó ser la más eficiente para inducir embriogénesis somática en Agave angustifolia. El 2,4-D demostró un efecto superior frente a ANA y AIA, consolidándose como el regulador clave para inducir la totipotencia celular. La alta tasa de aclimatación ex vitro valida la viabilidad práctica del protocolo propuesto, con amplias posibilidades de aplicación en conservación, mejoramiento genético y producción sustentable de agaves.
Referencias
Abas, L., Kolb, M., Stadlmann, J., Janacek, D. P., Lukic, K., Schwechheimer, C., Sazanov, L. A., Mach, L., Friml, J., & Hammes, U. Z. (2021). Naphthylphthalamic acid associates with and inhibits PIN auxin transporters. Proceedings of the National Academy of Sciences, 118(1), e2020857118. https://doi.org/10.1073/pnas.2020857118
Aguirre-Dugua, X., & Eguiarte, L. E. (2013). Genetic diversity, conservation and sustainable use of wild Agave cupreata and Agave potatorum extracted for mezcal production in Mexico. Journal of Arid Environments, 90, 36–44. https://doi.org/10.1016/j.jaridenv.2012.10.018
Alvarez-Aragón, C., Arzate-Fernandez, A.-M., Martínez-Martínez, S.-Y., & Martínez-Velasco, I. (2020). REGENERACIÓN DE PLANTAS DE Agave marmorata Roezl, VÍA EMBRIOGÉNESIS SOMÁTICA. Tropical and Subtropical Agroecosystems, 23(2). https://doi.org/10.56369/tsaes.3117
Álvarez-Ríos, G. D., Pacheco-Torres, F., Figueredo-Urbina, C. J., & Casas, A. (2020). Management, morphological and genetic diversity of domesticated agaves in Michoacán, México. Journal of Ethnobiology and Ethnomedicine, 16(1), 3. https://doi.org/10.1186/s13002-020-0353-9
Aronen, T., Varis, S., & Tikkinen, M. (2025). Somatic embryogenesis: concept, principles, and applications. En Forest Microbiology (pp. 373–388). Elsevier. https://doi.org/10.1016/B978-0-443-21903-0.00022-9
Ascough, G. D., & Fennell, C. W. (2004). The regulation of plant growth and development in liquid culture. South African Journal of Botany, 70(2), 181–190. https://doi.org/10.1016/S0254-6299(15)30234-9
Azizi, P., Rafii, M. Y., Maziah, M., Abdullah, S. N. A., Hanafi, M. M., Latif, M. A., Rashid, A. A., & Sahebi, M. (2015). Understanding the shoot apical meristem regulation: A study of the phytohormones, auxin and cytokinin, in rice. Mechanisms of Development, 135, 1–15. https://doi.org/10.1016/j.mod.2014.11.001
Bai, S., Chen, L., Yund, M. A., & Sung, Z. R. (2000). Mechanisms of plant embryo development. Current Topics in Developmental Biology, 50, 61–88. https://doi.org/10.1016/S0070-2153(00)50004-0
Batista-Silva, W., de Paiva Gonçalves, J., Siqueira, J. A., Martins, A. O., Ribeiro, D. M., Nunes-Nesi, A., Zsögön, A., & Araújo, W. L. (2024). Auxin metabolism and the modulation of plant growth. Environmental and Experimental Botany, 226, 105917. https://doi.org/10.1016/J.ENVEXPBOT.2024.105917
Bouchez, D., Uyttewaal, M., & Pastuglia, M. (2024). Spatiotemporal regulation of plant cell division. Current Opinion in Plant Biology, 79, 102530. https://doi.org/10.1016/j.pbi.2024.102530
Cárdenas-Aquino, M. D. R., Camas-Reyes, A., Valencia-Lozano, E., López-Sánchez, L., Martínez-Antonio, A., & Cabrera-Ponce, J. L. (2023). The Cytokinins BAP and 2-iP Modulate Different Molecular Mechanisms on Shoot Proliferation and Root Development in Lemongrass (Cymbopogon citratus). Plants, 12(20), 3637. https://doi.org/10.3390/plants12203637
Dávila, P., Arizmendi, M. D. C., Valiente‐Banuet, A., Villaseñor, J. L., Casas, A., & Lira, R. (2002). Biological diversity in the Tehuacán-Cuicatlán Valley, Mexico. Biodiversity and Conservation, 11(3), 421–442. https://doi.org/10.1023/A:1014888822920
Desai, P., Desai, S., Rafaliya, R., & Patil, G. (2022). Plant tissue culture: Somatic embryogenesis and organogenesis. En Advances in Plant Tissue Culture (pp. 109–130). Elsevier. https://doi.org/10.1016/B978-0-323-90795-8.00006-0
Domínguez-Rosales, M. S., Alpuche-Solís, Á. G., Vasco-Méndez, N. L., & Pérez-Molphe-Balch, E. (2008). EFECTO DE CITOCININAS EN LA PROPAGACIÓN in vitro DE AGAVES MEXICANOS. Revista Fitotecnia Mexicana, 31(4), 317. https://doi.org/10.35196/rfm.2008.4.317
Fehér, A. (2015). Somatic embryogenesis — Stress-induced remodeling of plant cell fate. Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms, 1849(4), 385–402. https://doi.org/10.1016/j.bbagrm.2014.07.005
Flores-Maya, S., Vargas-Jurado, M. Á., Suárez-Mota, M. E., & Barrera-Escorcia, H. (2015). Análisis cariotípico de Agave marmorata y A. peacockii (Agavaceae) ubicados en las terrazas aluviales del río Zapotitlán, Puebla, México. Polibotánica, 0(40). https://doi.org/10.18387/polibotanica.40.7
García-Mendoza, A. (2002). Distribution of agave (Agavaceae) in México.
Gulzar, B., Mujib, A., Malik, M. Q., Sayeed, R., Mamgain, J., & Ejaz, B. (2020). Genes, proteins and other networks regulating somatic embryogenesis in plants. Journal of Genetic Engineering and Biotechnology, 18(1), 31. https://doi.org/10.1186/s43141-020-00047-5
Gutiérrez-Mora, A., Rodríguez-Garay, B., Contreras-Ramos, S. M., Kirchmayr, M. R., & González-Ávila, M. (2014). SUSTAINABLE AND INTEGRAL EXPLOITATION OF AGAVE.
Jing, H., & Strader, L. C. (2019). Interplay of Auxin and Cytokinin in Lateral Root Development. International Journal of Molecular Sciences, 20(3), 486. https://doi.org/10.3390/ijms20030486
Li, D. Z., & Pritchard, H. W. (2009). The science and economics of ex situ plant conservation. Trends in Plant Science, 14(11), 614–621. https://doi.org/10.1016/J.TPLANTS.2009.09.005
Murashige, T., & Skoog, F. (1962). A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum, 15(3), 473–497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Pérez‐Zavala, M. D. L., Hernández‐Arzaba, J. C., Bideshi, D. K., & Barboza‐Corona, J. E. (2020). Agave: a natural renewable resource with multiple applications. Journal of the Science of Food and Agriculture, 100(15), 5324–5333. https://doi.org/10.1002/jsfa.10586
Radoeva, T., Vaddepalli, P., Zhang, Z., & Weijers, D. (2019). Evolution, Initiation, and Diversity in Early Plant Embryogenesis. Developmental Cell, 50(5), 533–543. https://doi.org/10.1016/j.devcel.2019.07.011
Reyes-Díaz, J. I., Arzate-Fernández, A. M., & Piña-Escutia, J. L. (2018). Fuentes de sacarosa y nitrógeno orgánico influyen en la embriogénesis somática de Agave angustifolia. Revista Mexicana de Ciencias Agrícolas, 9(7), 1508–1513. https://doi.org/10.29312/remexca.v9i7.1676
Reyes-Díaz, J. I., Arzate-Fernández, A. M., Piña-Escutia, J. L., & Vázquez-García, L. M. (2017). Media culture factors affecting somatic embryogenesis in Agave angustifolia Haw. Industrial Crops and Products, 108, 81–85. https://doi.org/10.1016/j.indcrop.2017.06.021
Schaller, G. E., Bishopp, A., & Kieber, J. J. (2015). The Yin-Yang of Hormones: Cytokinin and Auxin Interactions in Plant Development. The Plant Cell, 27(1), 44–63. https://doi.org/10.1105/tpc.114.133595
Su, Y. H., Liu, Y. B., & Zhang, X. S. (2011). Auxin-cytokinin interaction regulates meristem development. En Molecular Plant (Vol. 4, Número 4, pp. 616–625). Oxford University Press. https://doi.org/10.1093/mp/ssr007
Teale, W., & Palme, K. (2018). Naphthylphthalamic acid and the mechanism of polar auxin transport. Journal of Experimental Botany, 69(2), 303–312. https://doi.org/10.1093/jxb/erx323
Tian, R., Paul, P., Joshi, S., & Perry, S. E. (2020). Genetic activity during early plant embryogenesis. Biochemical Journal, 477(19), 3743–3767. https://doi.org/10.1042/BCJ20190161
Trejo, L., Soriano, D., Romano-Grande, E., Sánchez-Carmona, B., & Dávila-Navarro, D. E. (2024). Diversity of reproductive characters, seed set, and viability of Agave seeds used for pulque production and their wild relatives in Tlaxcala, Mexico. Genetic Resources and Crop Evolution, 71(6), 2877–2903. https://doi.org/10.1007/s10722-023-01803-5
Wang, F.-X., Shang, G.-D., & Wang, J.-W. (2022). Towards a hierarchical gene regulatory network underlying somatic embryogenesis. Trends in Plant Science, 27(12), 1209–1217. https://doi.org/10.1016/j.tplants.2022.06.002
Węgrzynowicz-Lesiak, E., Góraj, J., Miyamoto, K., Ueda, J., & Saniewski, M. (2013). Effects of auxin polar transport inhibitors on the growth of the excised fourth internode in tulips. Journal of Horticultural Research, 21(2), 31–39. https://doi.org/10.2478/johr-2013-0019
Zeng, F., Zhang, X., Cheng, L., Hu, L., Zhu, L., Cao, J., & Guo, X. (2007). A draft gene regulatory network for cellular totipotency reprogramming during plant somatic embryogenesis. Genomics, 90(5), 620–628. https://doi.org/10.1016/j.ygeno.2007.07.007
Zhang, W., Zhang, L., Jiang, W., Yang, H., Yang, T., Zhao, Y., Zhang, Z., & Ma, Y. (2025). DNA methylation regulates somatic stress memory and mediates plasticity during acclimation to repeated sulfide stress in Urechis unicinctus. Journal of Hazardous Materials, 487, 137264. https://doi.org/10.1016/J.JHAZMAT.2025.137264
Zizumbo-Villarreal, D., González-Zozaya, F., Olay-Barrientos, A., Platas-Ruíz, R., Cuevas-Sagardí, M., Almendros-López, L., & Colunga-GarcíaMarín, P. (2009). Archaeological Evidence of the Cultural Importance of Agave spp. in Pre-Hispanic Colima, Mexico. Economic Botany, 63(3), 288–302. https://doi.org/10.1007/s12231-009-9092-5
Descargas
Publicado
Número
Sección
Categorías
Licencia
Derechos de autor 2026 POLIBOTÁNICA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.

Polibotánica por Departamento de Botánica de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional se distribuye bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.



















